Pohjustuksena tuleville ravintoa ja muistisairauksia koskeville kirjoituksille, valaisen tässä kirjoituksessa sitä miten Alzheimerin tauti etenee, ja millaisia biomarkkereita voidaan käyttää taudin etenemiseen arviointiin jo ennen kuin muisti alkaa toden teolla reistailla.
Alzheimerin tauti muistuttaa kehityskulultaan ateroskleroottisia sairauksia
Alzheimerin tauti muistuttaa kehityskulultaan ateroskleroottisia sairauksia, kuten sepelvaltimotautia, ainakin kahdella keskeisellä tavalla. Molemmat sairaudet kehittyvät) hitaasti –”varkain”– vuosikymmenten aikana, ja vasta riittävän pitkälle edenneet muutokset hermosoluissa aiheuttavat sairauden puhkeamisen. Lisäksi molemmat sairaudet ovat b) monitekijäisiä, eli useat eri riskitekijät vaikuttavat kimpassa saaden yhdessä pahempaa aikaan kuin yksin; ja monien riskitekijöiden kertyminen samalle henkilölle lisää sairauden puhkeamisen riskiä eniten. (Muistisairaudet. Käypä Hoito -suositus 2023)
Alzheimerin taudin etenemisestä on kirjoitettu seikkaperäisesti Käypä Hoito -suosituksen Lisää tietoa, Alzheimerin tauti -artikkelissa (Ari Rosenwall 11.12.2023).
Monitekijäisyys ilmenee Alzheimerin taudissa muun muassa seuraavien tekijöiden yhteispelinä: beeta-amyloidi, tau-proteiini, astrosyyttien ja mikrogliasolujen häiriöt, veriaivoesteen häiriöt, glymfaattisen järjestelmän (aivoviemäri) häiriöt ja lisäksi sydän- ja verisuonitautien perinteiset riskitekijät sekä geneettinen alttius (apoE4) yhdessä kehittävät soppaa, josta lopulta syntyy Alzheimerin tauti. Katso sairauden syntyä koskeva edellinen kirjoitukseni.
”Muistisairauksia, myös Alzheimerin tautia (AT), voidaan todennäköisesti ehkäistä vaikuttamalla tunnettuihin riskitekijöihin, kuten kohonneeseen verenpaineeseen.” -Muistisairaudet, Käypä Hoito -suositus, Duodecim 2023
Alzheimerin taudin eteneminen
Alzheimerin tautia ennustaa noin 10-30 vuotta ennen sen puhkeamista aivoihin ”varkain” kertyvät beeta-amyloidin kertymät. Ne eivät aiheuta kantajalleen oireita, vaan hyvin hitaasti nakertavat aivoterveyttä –samaan tapaan kuin kohonnut LDL-kolesteroli ja verenpaine sepelvaltimotaudissa. Tämä on sairauden oireeton niin sanottu prekliininen vaihe –tämä olisi todennäköisesti otollinen aika erilaisille ehkäiseville toimenpiteille, joista lisää muissa kirjoituksissa.
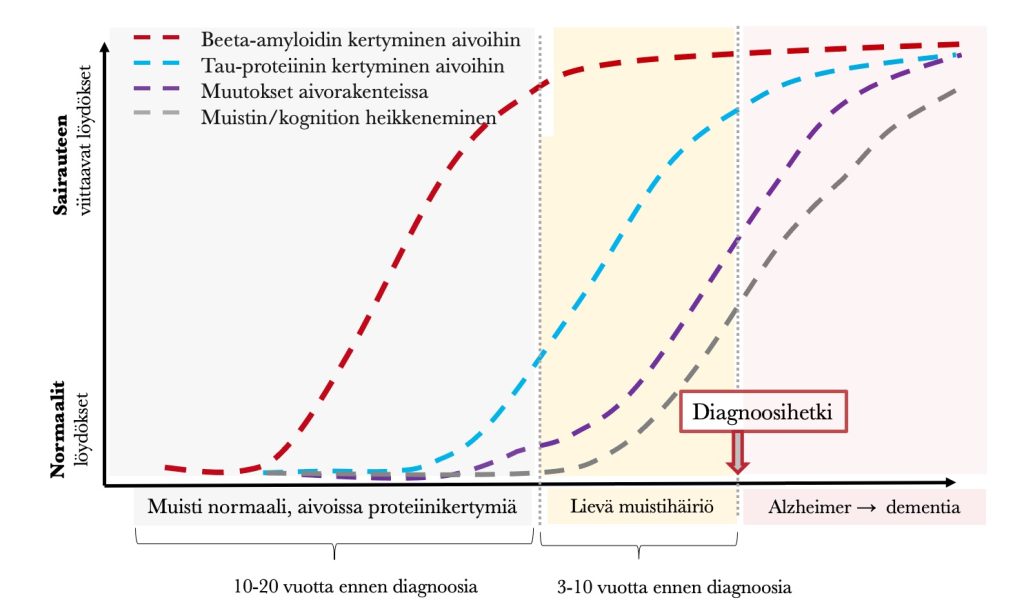
Mukaeltu lähteistä: Narasimhan S, Holtzman DM, Apostolova LG, Cruchaga C, Masters CL, Hardy J, Villemagne VL, Bell J, Cho M, Hampel H. Apolipoprotein E in Alzheimer’s disease trajectories and the next-generation clinical care pathway. Nat Neurosci. 2024 Jul;27(7):1236-1252. |Counts SE, et al. Biomarkers for the Early Detection and Progression of Alzheimer’s Disease. Neurotherapeutics. 2017;14(1):35-53 | | Yoshiyama Y, Lee VM, Trojanowski JQ. Therapeutic strategies for tau mediated neurodegeneration. J Neurol Neurosurg Psychiatry. 2013;84(7):784-95. Ilmoitetut vuosiarviot ovat viitteellisiä.
Alzheimerin taudin biomarkkerit
Alzheimerin taudin kulkua on aiemmin pystytty arvioimaan lähinnä selkäydinnesteestä (likvor) mitattavilla biomarkkereilla tai erilaisilla (kalliilla) aivojen kuvantamismenetelmillä. Verestä mitattavien biomarkkerien kehitys on ollut nopeaa viime vuosina, ja jotkin niistä ovat lyömänsä itsensä todella läpi hyvän spesifisyytensä ja sensitiivisyytensä vuoksi. (Barthélemy et al. 2024, Janelidze et al. 2024, Ossenkoppele et al. 2022)
Tau-kertymät voidaan myöskin havaita aivoissa (PET-kuvauksessa), yleensä noin 10 vuotta myöhemmin kuin beeta-amyloidin kertymät. Verestä tai selkäydinensteestä (likvorista) mitatut fosforyloituneet tau-proteiini217 tai -231 (ptau217 tai pTau231) korreloivat varsin hyvin aivoihin kertyneen beeta-amyloidin kanssa. Matalan Aβ42/40 -suhteen ja pTau217:n yhdistäminen ennustaa erittäin hyvin aivojen beeta-amyloidikuormaa.
Tällä hetkellä ehkä käytännöllisin tapa ennustaa mahdollista tulevaa Alzheimerin tautia on yhdistää geneettinen tieto (sukurasite/apoE4-geeni) verestä mitattaviin korkeaan pTau217:ään ja matalaan Aβ42/40:n -suhteeseen. Näiden kahden biomarkkerin tasot veressä muuttuvat huomattavasti aiemmin kuin muistissa havaitaan edes ensimmäisiä selviä heikkenemisen merkkejä. Validoitujen muistitestien normaalia heikompi tulos vahvistaa luonnollisesti löydöstä, mutta muistitoimintojen heikkeneminen seuraa usein vuosien viiveellä suhteessa edellä mainittuihin veri- tai likvoriarvoihin. (Narasimhan et al. 2024, Blennow & Hansson 2024, Jessen et al. 2024)
Kun beeta-amyloidia ja tau-proteiinia on kertynyt aivoihin riittävän monta vuotta siirrytään normaalista kognitiivisesta toiminnasta eteenpäin sairausjatkumolla ➝ lievä muistihäiriö (mild cognitive impairment eli MRI/prodromaalinen Alzheimerin tauti) ➝ Alzheimerin tauti ➝ dementia (loppuvaiheen muistisairaus). Käytännössä prosessi alkaa yleensä muistioireista ja päättyen siihen, että ihminen ei kykene huolehtimaan itsestään lainkaan. Alzheimerin taudin oireiden pääsääntöinen oireiden ilmaantumisjärjestys kuvataan seuraavasti:
1.Muistitoimintojen häiriintyminen
2.Maantieteelliseen paikkaan ja aikaan orientaatio heikkenee; päivämäärien, kellonaikojen, juhlapäivien ja vuoden aikojen hahmottuminen tulee vaikeammaksi
3.Ongelmanratkaisukyky ja harrastukset kärsivät. Esimerkiksi laskutehtävät vaikeutuu, tietokoneen käyttö, uutisten seuraaminen vähenee ja taloudellisten asioiden hoitaminen heikkenee.
4.Sosiaalisen elämän taidot ja ulottuvuudet heikkenevät. Henkilö eristäytyy, estot vähenevät, aggressiot ja muut luonnehäiriöt lisääntyvät.
5.Lopuksi itsestä huolehtiminenkin käy mahdottomaksi (hygienia, pukeutuminen syöminen jne.)
Yksityiskohtainen kuvaus Alzheimerin taudin kulusta: Käypä Hoito -suosituksen Lisää tietoa, Alzheimerin tauti -artikkeli (Ari Rosenwall 11.12.2023).
Tutkimuskirjallisuudessa esiintyy usein termi subjektiivinen muistihäiriö, subjective cognitive decline/impairment (SCD/SCI). Tämä tila yleensä edeltää lievää muistihäiriötä (MCI, Mild Cogntive Impairment), ja sitä leimaa nimien subjektiivisesti koettu unohtelu, niin sanottu hyvälaatuinen hajamielisyys ja terveydenhuoltoon yhteydenotto. Varsinaisten muistitestien tulokset ovat yleensä SCI:ssä normaalit, kun taas muistitn heikkenemistä havaitaan MCI-vaiheessa. Subjektiivisesta muistihäiriöistä kärsivillä voi olla lievästi kohonnut muistisairauden riski. (Jessen ym. 2020)
Alla oleva kuva summaa edellä kerrottua. Edellisessä kirjoituksessa mainittu aivojen glukoosin käytön heikkeneminen on myös sairauden edetessä etenevä ilmiö, ja se alkaa vähetä noin 20 vuotta ennen sairastumista. (Bateman et al. 2012)
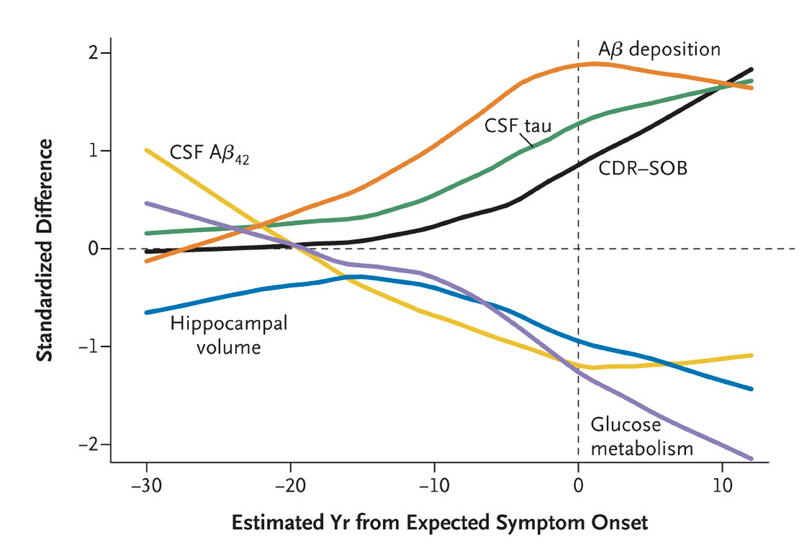
Bateman RJ et al. Dominantly Inherited Alzheimer Network. Clinical and biomarker changes in dominantly inherited Alzheimer’s disease. N Engl J Med. 2012 Aug 30;367(9):795-804.(CSF=selkäydineste, CDR-SOB=eräs paljon käytetty kognitio-/toimintakykytesti, Aβ=Beeta-amyloidi, Aβ42=erityisen ärhäkästi aivoihin pakkautuva ja siksi vaikeasti aivoista poistettava ja siksi sen määrä vähenee veressä ja likvorissa sairauden edetessä)
Alla olevassa kuvassa edellä esitetty asia hieman toisella tavalla ilmaistuna, ja osin eri biomarkkerivalinnoin.
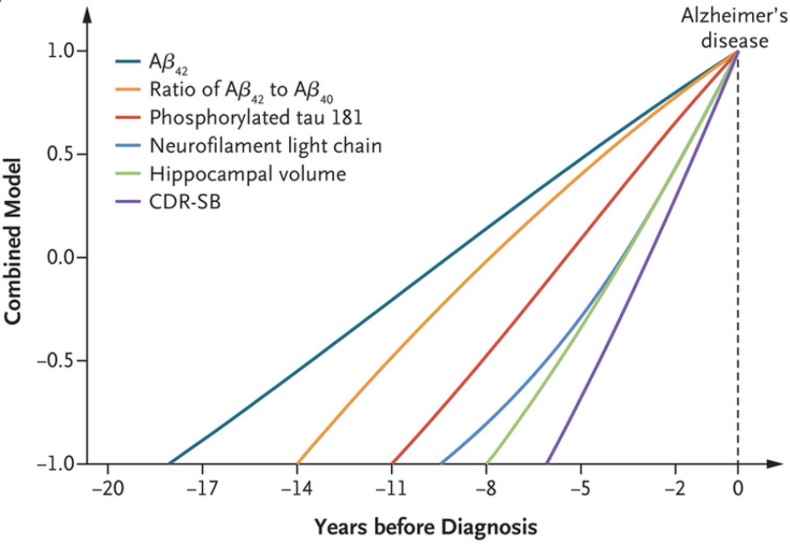
Jia J, et al. Biomarker Changes during 20 Years Preceding Alzheimer’s Disease. N Engl J Med. 2024;390(8):712-722.
Aiemmin kirjoitin yleisimmän Alzheimerin taudin riskigeenin apolipoproteiini E4:n (apoE4) merkityksestä. Viimeisten viiden vuoden aikana on tullut runsaasti tutkimusta, jossa aivoihin kertyvää beeta-amyloidin ja tau-proteiinin määrää on iän funktiona suhteutettu eri apoE-geenityyppeihin. Alla oleva kuva havainnollistaa asiaa; suurimmat riskin sairastua Alzheimerin tautiin (AD) omaavat apoE4/4-geenin kantajat ja pienimmän apoE2/2 -geenin kantajat.
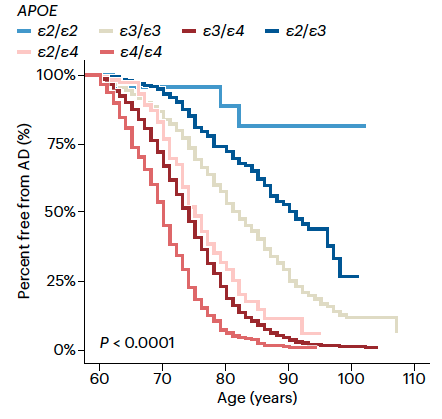
ApoE-geenin vaikutus Alzheimerin taudista ”vapaana” pysymiseen (free from AD) iän funktiona. Narasimhan S, et al. Apolipoprotein E in Alzheimer’s disease trajectories and the next-generation clinical care pathway. Nat Neurosci. 2024;27(7):1236-1252.
Riskiä lisäävä apoE4 ja sitä vähentävä apoE2 -geeni vaikuttavat ainakin kahteen keskeiseen Alzheimerin taudin mekanismiin. ApoE4-geeni aikaistaa ja apoE2 -geeni viivästyttää sekä beeta-amyloidin plakkien (Aβ burden) että tau-proteiini vyyhtien (tau burden) kertymistä aivoihin (kuva alla).
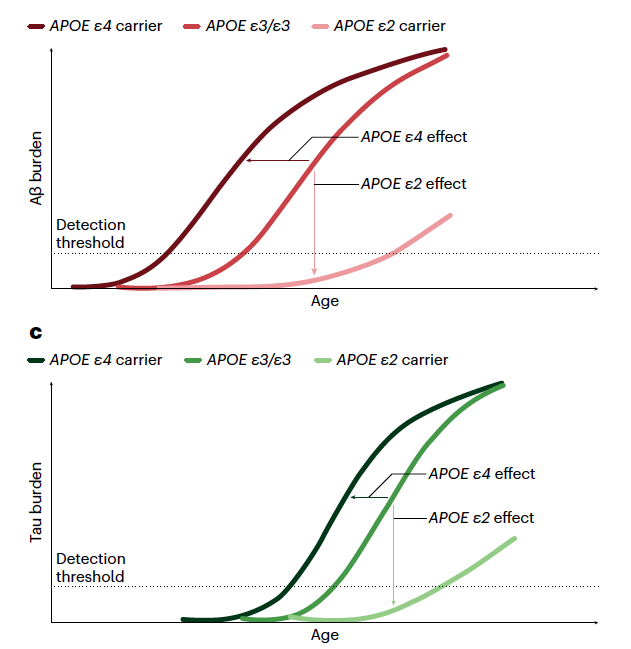
Narasimhan S, et al. Apolipoprotein E in Alzheimer’s disease trajectories and the next-generation clinical care pathway. Nat Neurosci. 2024 Jul;27(7):1236-1252. (Aβ burden=beeta-amyloidin plakkien kertyminen aivoihin, tau burden=tau-proteiini vyyhtien kertyminen aivoihin)
Kaikki edellä mainittu korostaa sitä, että muistisairauksia ei voi tehokkaasti estää, ellei tapahtumien kulkuun puututa vähintään 10-20 vuotta ennen kuin selvää muistin heikkenemistä. Viimeistään keski-iässä on järkevä panostaa terveelliseen ruokavalioon ja muihin elämäntapamuutoksiin, joilla voidaan yhtä aikaa vähentää riskiä sairastua sekä sydän- ja verisuonitauteihin että Alzheimerin tautiin ja vaskulaariseen muistisairauteen.
Äskettäin julkaistu konsensuslausuma toteaakin (vapaa käännös):
”On todennäköistä, että selvät myönteiset vaikutukset [Alzheimerin taudin kulkuun] saavutetaan vasta erilaisilla 1) yhdistelmähoidoilla, 2) biomarkkereihin [erityisesti veriarvoihin ja geenitietoon] pohjautuvalla potilasvalinnalla ja 3) paljon aikaisemmin aloitettavalla hoidolla.” – Progress in the Treatment of Alzheimer’s Disease Is Needed – Position Statement of European Alzheimer’s Disease Consortium (EADC) Investigators. J Prev Alz Dis 2024
Alzheimerin taudin monien keskeisten mekanististen piirteiden selviämisestä huolimatta, lienee hyvä korostaa Alzheimerin taudin patofysiologian olevan vielä monien nyanssien osalta hämärän peitossa –ja muun muassa sen vuoksi tehokkaiden lääkkeiden keksiminen on todella haastavaa. Keskeisin ongelma Alzheimerin taudin ehkäisemiseksi saattaa silti olla se, että sairaus on edennyt liian pitkälle ennen kuin se tunnistetaan ja ryhdytään sitä hoitamaan –millä tahansa tehokkaaksi ennakoidulla hoidolla.
Lähteet
Barthélemy NR, Salvadó G, Schindler SE, He Y, Janelidze S, Collij LE, Saef B, Henson RL, Chen CD, Gordon BA, Li Y, La Joie R, Benzinger TLS, Morris JC, Mattsson-Carlgren N, Palmqvist S, Ossenkoppele R, Rabinovici GD, Stomrud E, Bateman RJ, Hansson O. Highly accurate blood test for Alzheimer’s disease is similar or superior to clinical cerebrospinal fluid tests. Nat Med. 2024;30(4):1085-1095.
Blennow K & Hansson O. Blodtest – fönster till hjärnan vid Alzheimers sjukdom. Läkartidningen 2024;121:23150
Janelidze S, Barthélemy NR, Salvadó G, Schindler SE, Palmqvist S, Mattsson-Carlgren N, Braunstein JB, Ovod V, Bollinger JG, He Y, Li Y, Raji CA, Morris JC, Holtzman DM, Ashton NJ, Blennow K, Stomrud E, Bateman RJ, Hansson O. Plasma Phosphorylated Tau 217 and Aβ42/40 to Predict Early Brain Aβ Accumulation in People Without Cognitive Impairment. JAMA Neurol. 2024;81(9):947-957.
Jessen F, Amariglio RE, Buckley RF, van der Flier WM, Han Y, Molinuevo JL, Rabin L, Rentz DM, Rodriguez-Gomez O, Saykin AJ, Sikkes SAM, Smart CM, Wolfsgruber S, Wagner M. The characterisation of subjective cognitive decline. Lancet Neurol. 2020 Mar;19(3):271-278.
Jessen F, et al. Progress in the Treatment of Alzheimer’s Disease Is Needed – Position Statement of European Alzheimer’s Disease Consortium (EADC) Investigators. J Prev Alzheimers Dis. 2024;11(5):1212-1218.
Mielke MM, et al. Recommendations for clinical implementation of blood-based biomarkers for Alzheimer’s disease. Alzheimers Dement. 2024;20(11):8216-8224.
Muistisairaudet. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin, Societas Gerontologica Fennican, Suomen Geriatrit -yhdistyksen, Suomen Neurologisen Yhdistyksen, Suomen Psykogeriatrisen Yhdistyksen ja Suomen Yleislääketieteen yhdistyksen asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2023 (26.11.2024). Saatavilla internetissä: www.kaypahoito.fi
Narasimhan S, Holtzman DM, Apostolova LG, Cruchaga C, Masters CL, Hardy J, Villemagne VL, Bell J, Cho M, Hampel H. Apolipoprotein E in Alzheimer’s disease trajectories and the next-generation clinical care pathway. Nat Neurosci. 2024;27(7):1236-1252.
Palmqvist S, Tideman P, Mattsson-Carlgren N, Schindler SE, Smith R, Ossenkoppele R, Calling S, West T, Monane M, Verghese PB, Braunstein JB, Blennow K, Janelidze S, Stomrud E, Salvadó G, Hansson O. Blood Biomarkers to Detect Alzheimer Disease in Primary Care and Secondary Care. JAMA. 2024;332(15):1245-1257.
Ossenkoppele R, van der Kant R, Hansson O. Tau biomarkers in Alzheimer’s disease: towards implementation in clinical practice and trials. Lancet Neurol. 2022 Aug;21(8):726-734.
Scheltens P, De Strooper B, Kivipelto M, Holstege H, Chételat G, Teunissen CE, Cummings J, van der Flier WM. Alzheimer’s disease. Lancet. 2021;397(10284):1577-1590
