Aion kirjoitella yhä enemmän aivoterveydestä ja ruokavaliosta. Pohjustuksena näille kirjoituksilla, valaisen kahdessa eri tekstissä muistisairauksien patofysiologiaa, koska olen huomannut siitä tiedettävän keskimäärin paljon vähemmän kuin sydän- ja verisuonisairauksien tausta- ja riskitekijöistä.
Tässä kirjoituksessa käyn läpi, miten tavallisimmat muistisairaudet syntyvät. Seuraavassa kirjoituksessani sitä millaisella nopeudella ja missä järjestyksessä aivomuutokset etenevät. Näiden kirjoitusten jälkeen käsittelen eri muistisairauksien riskiä lisääviä ja vähentäviä riskitekijöitä, elämäntapatekijöitä ja erityisesti ravinnon merkitystä.
Johdanto: Muistin ja kognitiivisten toimintojen heikkenemistä aiheuttavat yleisimmät sairaudet
Kognitioon eli aivojen tiedon käsittelyyn liittyvät häiriöt – muistisairaudet – yleistyvät väestömme vanhetessa. Usein puhutaan dementiasta.
Dementia pitäisi kuitenkin rajata koskemaan muistisairauksien lopputilaa, jossa muistihäiriön lisäksi myös toimintakyky on voimakkaasti alentunut tai loppunut. Muistisairaus täyttää siis dementian kriteerit vasta loppuvaiheessaan, alkava muistisairaus on muistisairaus, joka saattaa pahimmillaan johtaa dementiaan, mutta ei välttämättä. (Strandberg 2017)
Muistitoimintojen heikkenemisen taustalla, ja lopulta siis myös dementian taustalla, ovat aivoissa tapahtuvat muutokset, jotka voidaan jakaa seuraaviin luokkiin (Knopman ym. 2021, kuva alla):
1) Alzheimerin tauti
2) Verisuoniperäiset, eli vaskulaariset aivoja rappeuttavat sairaudet
3) Hippokampuksen skleroosi
4) Muut muistisairaudet kuten otsolohkon rappeuma, Levyn kappaletauti, Parkinsonin aiheuttama muistisairaus ja muut pienemmät muistisairauksien aiheuttajat
70-vuotiaista karkeasti ottaen joka kymmennellä on joku edellä mainituista sairauksista diagnosoitavissa, ja 100-vuotiaksi elävistä kahdella kolmesta on joku näistä muistisairauksista (Knopman ym. 2021).
Alzheimerin tauti ilmaantuu keskimäärin aiemmin kuin vaskulaarinen muistisairaus. Verisuoniperäiset syyt (vaskulaarinen muistisairaus) korostuvat noin 10-15 vuotta Alzheimerin tautia myöhemmin eli noin 80-95 -vuoden iässä. Otsolohkorappeuman ja Levyn kappaletaudin esiintyvyys lisääntyy kaikkein aikaisimmin, jo 10 vuotta Alzheimerin tautia aiemmin eli noin 55-vuoden iästä eteenpäin. (Kuva alla, Knopman ym. 2021)
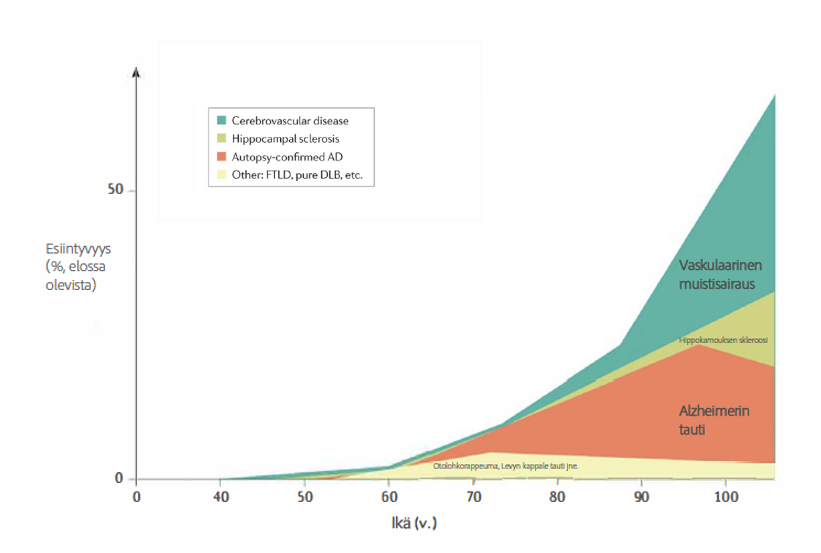
Mukaeltu artikkelista: Neuropathological diagnoses that cause cognitive impairment across the age spectrum. Knopman DS, Amieva H, Petersen RC, Chételat G, Holtzman DM, Hyman BT, Nixon RA, Jones DT. Alzheimer disease. Nat Rev Dis Primers. 2021 May 13;7(1):33.
Edellisestä kuvasta voidaan päätellä, että kaksi suurinta muistisairauksia aiheuttavaa sairautta ovat Alzheimerin tauti (punainen alue) ja vaskulaariset, aivoverisuonia rappeuttavat, sairaudet (vihreä alue). Hippokampuksen skleroosista johtuvaa muistihäiriötä voi esiintyä epilepsian, sydänpysähdyksen, vakavan hypoglykemian, aivovamman tai muun aivojen vakavan hapenpuutteen aiheuttavan syyn vuoksi.
Alzheimerin taudin ja yleensä dementian esiintyvyys Suomessa ja muualla
Alzheimerin taudin ja siihen liittyvän dementian esiintyvyys on Suomessa samaa luokkaa kuin muissa läntisen Euroopan maissa. Ikävakioitu esiintyvyys (vihreät viivat alla kuvassa) ei lisäänny vaan jopa hitaasti vähenee (Global Burden of Disease Collaborative Network, 2024). Sen sijaan absoluuttinen sairaiden määrä (punainen viiva kuvassa alla) lisääntyy väestön vanhenemisen vuoksi –ikähän on Alzheimerin taudin itsenäinen riskitekijä, kuten edellä esitetty kuvakin kertoi.
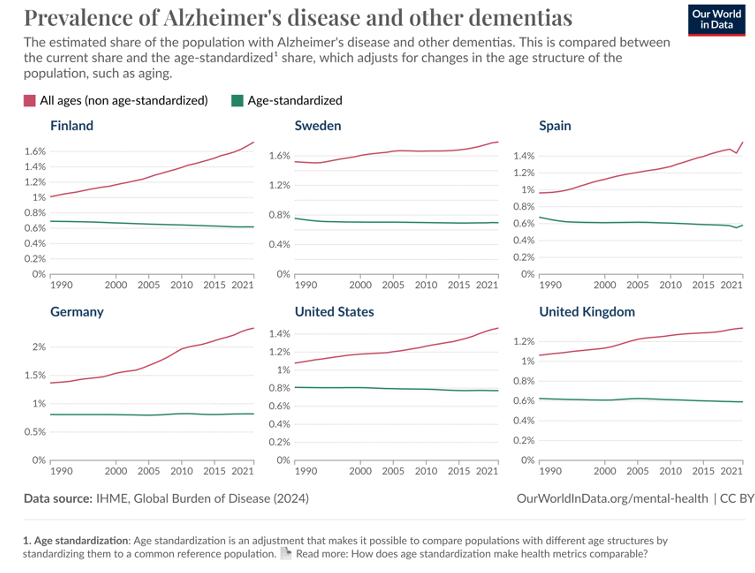
Alzheimerin taudin ja muiden mahdollisesti dementiaksi etenevien muistisairauksien yleisyys eri maissa (ei-vakioitu: punaisella ja ikävakioitu: vihreällä)
Pidän tärkeänä huomauttaa, että Alzheimerin taudin ikävakioitu ilmaantuvuus ei lisäänny huolimatta viimeisen 10-20 vuoden aikana parantuneesta diagnostiikasta –tämä saattaa viitata siihen, että sydän- ja verisuonisairauksien riskitekijöiden tehokas hoito ja sotien jälkeistä aikaa terveellisempi ruokavalio sekä vähäisempi tupakointi osaltaan selittävät ikävakioidun ilmaantumisen pysymistä ennallaan tai jopa hienoista vähenemistä –huolimatta parantuneesta diagnostiikasta. Useissa länsimaissa on samankaltainen tilanne kuin Suomessa (Global Burden of Disease Collaborative Network, 2024), Suomessa tilanne ei ainakaan tämän tilaston valossa näytä huolestuttavammalta kuin muualla.
Kaikissa löytämissäni aikasarjoissa, kuten tässä, on sama ongelma, ne niputtavat yhteen Alzheimerin taudin ja muut dementiat. Sen sijaan ikävakioitua Alzheimerin taudin ilmaantuvuutta ilman dementiaksi edennyttä sairautta, ei ilmeisesti löydy Euroopan maissa ajan funktiona.
Alzheimerin taudin yksinkertaistettu patofysiologia
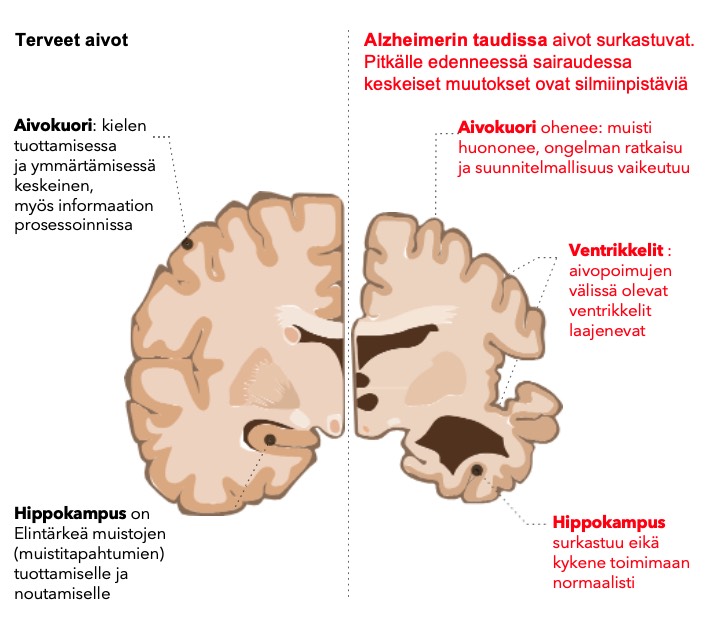
Alzheimerin tauti poikkeaa syntymekanismiltaan edellä mainitusta vaskulaarisesta muistisairaudesta siten, että Alzheimerin taudissa rapistuu alun alkujaan aivojen hermotoiminta, ei aivoverisuonet. Tarkemmin sanoen hermosolujen eli neuronien tuman sisältävä solukeskus, sen tuojahaarakkeen (dendriinit) ja viejätupet (aksonit) surkastuvat aiheuttaen hermosolujen rappeutumisen. Tässä esitettävä patofysiologia on yksinkertaistus.
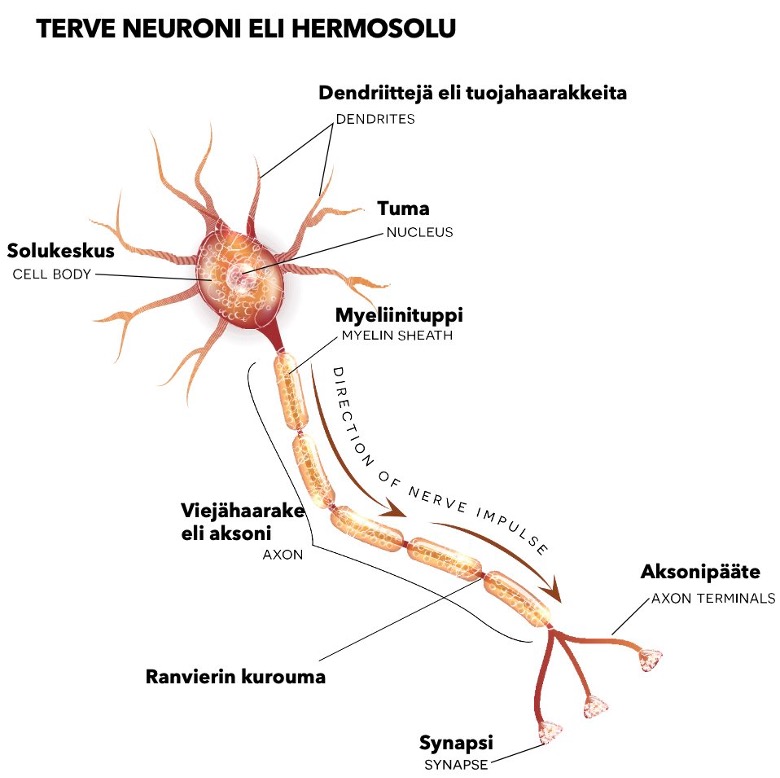
Hermosolut eri neuronit ovat inhimillistä toimintaa johtavat aivosolumme. Niiden vauriot ja surkastuminen aiheuttaa Alzheimerin tautia ja muita muistisairauksia.
Hermosolujen kuolema aivoissa tapahtunee pääasiassa kahden eri proteiinin kokkaroitumisen ja verkkomuodostelman yhteistuloksena; nämä proteiinit ovat nimeltään beeta-amyloidin (Aβ) ja tau-proteiini. Rappeuttavaa prosessia vahvistaa ja nopeuttaa mikrogliasolujen ja astrosyyttien toiminnan vioittuminen. (Scheltens ym. 2021)
Beeta-amyloidin kertyminen aiheuttaa solun ulkoisia plakkeja, sakkautumista solukeskuksen ja dendrittien läheisyyteen ja tau-proteiini puolestaan luo risukasan kaltaista verkkokudosta (fibrin tangles) aksonin ympärille ja myöhemmin muuallekin hermosolun sisälle, tukahduttaen neuronin.
Oheiset videot valaisevat Alzheimerin taudin mekanismia. Suosittelen katsomaan ne läpi.
Yhdysvaltojen terveysvirasto (National Institute of Health, NIH): How Alzheimer’s changes the brain, 4 min
Osmosis from Elsevier: Alzheimer’s disease – plaques, tangles, causes, symptoms & pathology, 8 min
Beeta-amyloidin rooli
Kaikilla ihmisillä on aivoissa neuronien solukalvossa proteiinia nimeltään amyloidi prekursori proteiini (APP). Sen tärkeä tehtävä on auttaa neuronia kasvamaan normaalisti ja korjata mahdollisia neuroniin tulevia vaurioita.
APP:n suoritettua tehtäväänsä riittävän kauan, se vanhenee ja pilkkoutuu sekä pilkkoutuneet osat hävitetään kahden entsyymin (alfa/𝛼-sekretaasin ja gamma/𝛾-sekretaasin) vaikutuksesta –näin syntynyt aine on pääosin liukoista amyloidia, joka on aivoista helposti pois raivattavaa jätettä –eikä siis aiheuta merkittävästi ongelmia aivotoiminnalle.
Olemassa on kuitenkin myös beeta (β)-sekretaasi-entsyymi, joka myös pilkkoo aikansa elänyttä APP:tä mutta tämän entsyymin toiminnan lopputuloksena onkin ei-liukoinen beeta-amyloidi (Aβ) –ja sen hävittäminen on puolestaan vaikeaa. Syntyvää beeta-amyloidia kertyy neuronien ulkopuolelle (ekstrasellulaariseen tilaan).
Edelleen viimeisten vuosien aikana on havaittu, että myös samaan sekretaasi-entsyymien sarjaan kuuluva delta-sekretaasi (δ-sekretaasi) joka tuottaa toimintansa tuloksena myös ei-liukoista beeta-amyloidia (Zhang ym 2020). δ-sekretaasin määrä lisääntyy ikääntyessä ja apoE4-geenin kantajilla. δ-sekretaasi esiintyy tieteellisessä kirjallisuudessa myös nimellä asparagiini endopeptidaasi (AEP).
Kiinnostava uudehko tutkimuslinja on, että delta-sekretaasin jarruttaminen farmakologisesti tai joillakin ravintovalinnoilla voisi vähentää sekä beeta-amyloidin että tau-saostumien muodostusta. Delta-sekretaasin tuotantoa/aktivaatiota voidaan vähentää estämällä CAAT-edistäjän sitojaproteiinia (C/EBPβ), ja täten Alzheimerille tyypilliset aivomuutokset vähenevät: koe-eläin näyttöä aiheesta jo löytyy. C/EBPβ voi estää joko lääkeaineella tai joillakin ravintotekijöillä. (Yao ym. 2024)
Beeta-amyloidia muodostuu aivoissa enemmän erityisesti heillä, joilla on apolipoproteiini E4-geeni, joko apoE3/4 tai E4/4; katso tarkemmin tästä kirjoituksesta. Beeta-amyloidia kertyy ensiksi hippokampukseen, sitten myös edetessään kaikkiin aivolohkoihin aiheuttaen paitsi muistiongelmia myös monenlaista inhimillistä toimintakyvyn rapistumista. Hippokampus on siis ensimmäinen ”hittiä” ottava aivoalue.
Beeta-amyloidia on useita muotoja, mutta Aβ-lajien ehkäpä toksisin muoto, ja muodostuvien kokkareiden (plakkien) ensisijainen komponentti, on Aβ42.
Beeta-amyloidin Aβ40 -muotoa muodostuu myös (yhtä?) runsaasti, mutta se ei keräänny plakkeihin yhtä hanakasti, vaan sen poistaminen glymfaattisen järjestelmän (”aivoviemärijärjestelmä”) kautta on helpompaa kuin Aβ42:n –ja siksi sitä voidaan mitata selkäydinnesteestä ja verestä paljon suurempia pitoisuuksia kuin toksisempaa Aβ42:tä –jonka raivaaminen aivoista on työläämpää. Aβ40:n runsas määrä veressä tai selkäydinnesteessä kertoo beeta-amyloidin voimakkaasta muodostumisesta aivoissa, kun taas Aβ42:n vähäinen määrä veressä tai selkäydinnesteessä samaan aikaan (veressä tai selkäydinnesteessä) kertoo Aβ42:n kertymisestä beeta-amyloidiplakeiksi aivoihin. Aβ42/40:n matala suhde veressä tai selkäydinnesteessä kertoo siis vahingollisesta beeta-amalyloidin kertymisestä aivoihin.
On olemassa myös toissijainen, myöhäsyntyisempi tapa, jolla beeta-amyloidi aiheuttaa muistisairauksia hermosolutuhon alettua. Beta-amyloidi (sekä 40 että 42 alamuoto) voi kertyä kertyä hermosolujen ulkopuolelle pienten ja keskisuurten aivoverisuonien seinämiin aiheuttaen amyloidiangiopatiaa eli aivoverisuonten rappeutumista. Amyloidiangiopatia johtaa usein pinnallisiin aivoverenvuotoihin. Aivoverenvuodot voivat aiheuttaa paitsi halvausoireita ja muita neurologisia oireita, myös muistin heikkenemistä.
Tau-proteiinin rooli
Tau-proteiini on myös aivan normaali ja hermosolun toiminnalle tärkeä proteiini. Se vahvistaa hermosolun aksonia tarttumalla aksonin sisällä olevien mikrotubuluksien pinnalle pitkittäisenä ”tukipalikkana” (kuvassa alla sinisellä).
Tau-proteiinin haitallinen prosessi alkaa, kun laskostuttuaan ja fosforiin liityttyään tau-proteiini irtoaa aksoneista, irrallaan vaeltavat tau-proteiinit siirtyvät vähin erin hermosolun eri osiin ja muodostavat helposti verkkomaisia rakenteita (fibrin tangles). Nämä verkkomaiset vyyhdit voivat vähitellen tukahduttaa hermosolun. Erityisen haitallisena pidetään nykykäsityksen mukaan tau-oligomeerejä.
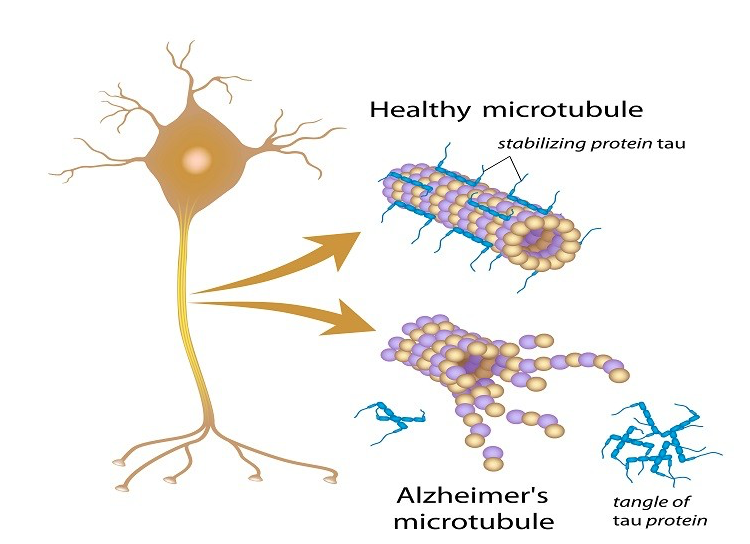
Tau-proteiini tukee hermosolun viejähaarakkeen mikrotubulus-rakenteita. Kun Tau-proteiini fosforyloituu (muuntuu haitalliseen muotoon), se irtoaa mikrotubuksesta muodostan tau-proteiinivyyhtejä (sakkaumia).
Tau-vyyhtien kertyminen saa alkunsa kun Tau-proteiini laskostuu (taittuu) ja fosforyloituu, jolloin se ei enää pysy mikrotubulusten päällä tukirakenteena. Tau-proteiinin fosforyloituminen ja laskostuminen on siis vahingollista, ja johtaa tau-vyyhtien, proteiinisakkautumien, muodostumiseen.
Aiemmin mainittu delta-sekretaasi (δ-sekretaasi) on ilmeisesti keskeinen tau-proteiinin vahingollista muuntumista kiihdyttävä tekijä (Zhang ym. 2014). Delta/δ-sekretaasin määrä lisääntyy ikääntyessä ja myös henkilöillä, joilla on apoE4 -geeni –näin ollen tämä δ-sekretaasi tulee sidotuksi kahdella eri mekanismilla kahteen keskeiseen mekanismiin: tau-proteiinin ja beeta-amyloidin kertymiseen Alzheimerin taudissa.
Deltasekretaasi aktivoituu myös follikkeleita stimuloivan hormonin (FSH):n vaikutuksesta (Xiong ym 2023). FSH:n eritys lisääntyy naisilla moninkertaiseksi vaihdevuosien aikaan. FSH:n korkea pitoisuus vaihdevuodet ohittaneilla naisilla saattaisi olla yksi selittäjä sille, että Alzheimerin riski on naisilla suurempi kuin miehillä.
Astrosyyttien ja mikroglia-solujen myötävaikuttavat vauriot
Mikrogliasolujen tehtävä on auttaa hermosoluja puhdistumaan jätteestä. Mikrogliasolut syövät beta-amyloidia, mutta muuntuneen beta-amyloidi (Aβ42 tai Aβ43) ”syöminen” (fagosytoosi) aiheuttaa mikrogliasolussa ärsytystä ja tulehdusaineiden erittymistä solusta –ja syntyneet tulehdusaineet edistävät rappeutumista hermosoluissa monin eri mekanismein. Mikrogliasolujen toiminta voi myös häiriintyä niin, juuri muuntuneiden tau-proteiinien ja beta-amyloidien vuoksi, että se ryhtyy häiriintyneesti syömään hermoliitoksia, synapseja, aiheuttaen lisää hermosolutuhoa.
Myös seuraava tutkimus viittaa mikroglian tärkeään rooliin Alzheimerin taudin patofysiologiassa. Vuonna 2024 julkaistussa tutkimuksessa havaittiin, että muistitoimintoja heikentää aivojen myös kynureniinin aineenvaihduntareitin (Kynurenine pathway) liika aktiivisuus Alzheimerin taudissa. Kynureenin runsas muodostuminen vähentää välivaiheiden kautta aivojen energiaravintoaineen laktaatin (muodostuu glukoosista aivoissa) määrää, ja laktaatin puute puolestaan lisää hermosoluvaurioita. Tämä havainto viittaa siihen, että normaalien muistitoimintojen kannalta on tärkeää riittävä ”polttoaineen” (laktaatti) saatavuus aivoissa, ja laktaatin puute näyttää lisäävän nimenoman mikroglian vaurioitumista, ja erityisesti mikroglian tulehdusreaktioita. Kynureniinireitin aktiivisuuden vähentäminen lääkeaineella (IDO-entsyymin estäjä), ja siten laktaatin tuotannon lisääminen (enemmän energiaa aivosoluilla), esti muistihäiriön kehittymistä koe-eläimillä (Minhas ym. 2024).
Astrosyytit puolestaan toimivat keskeisenä välittäjä soluna hermosolun ja aivoverisuonen välillä. Astrosyytin tehtävä on esimerkiksi auttaa puhdistamaan aivojen jätekuormaa verenkiertoon ja sitä kautta maksaan, jossa varsinainen puhdistaminen jätteestä yleensä tapahtuu. Astrosyytit ovat siis tärkeä solutyyppi paitsi niin sanotun ”aivoviemärin”, glymfaattisen järjestelmän, niin myös pitävän aivo-veriesteen (blood-brain barrier), toiminnassa.
Alzheimerin taudissa havaitaan aineenvaihdunnaltaan ylireagoivia astrosyyttejä (reactive astrocytes); kertyneen ja muuntuneen beeta-amyloidin ja tau-proteiinin, ja mahdollisesti muiden tekijöiden, vuoksi. Astrosyyttien vioittunut toiminta heikentää aivojen sokerin käyttöä, tekee aivo-veriesteestä huonommin pitävän, heikentää glymfaattisen järjestelmän (aivoviemärin) toimintaa, kalsiumvälitteistä signaalin välitystä ja hermokudoksen verenkiertoa (hypoperfuusio). (Price ym. 2021)
Alzheimerin taudin keskeisinä syytekijöinä pidetään siis 1) beetamyloidin ja 2) tau-proteiinin sakkautumista aivoihin, ja näihin tekijöihin kiinteästi liittyy myös 3) mikroglia-solujen ja 4) astrosyytti-solujen vikaantunut toiminta (mikroglioosi ja astroglioosi) aiheuttaen esimerkiksi aivoviemärin hidastunutta toimintaa sekä aivoveriesteen läpäisevyyden lisääntymistä –yhdessä nämä tekijät aiheuttavat hermosolutuhoa aivoissa. Nämä neljä keskeistä tekijää on kuvattu alla olevaan kuvaan.
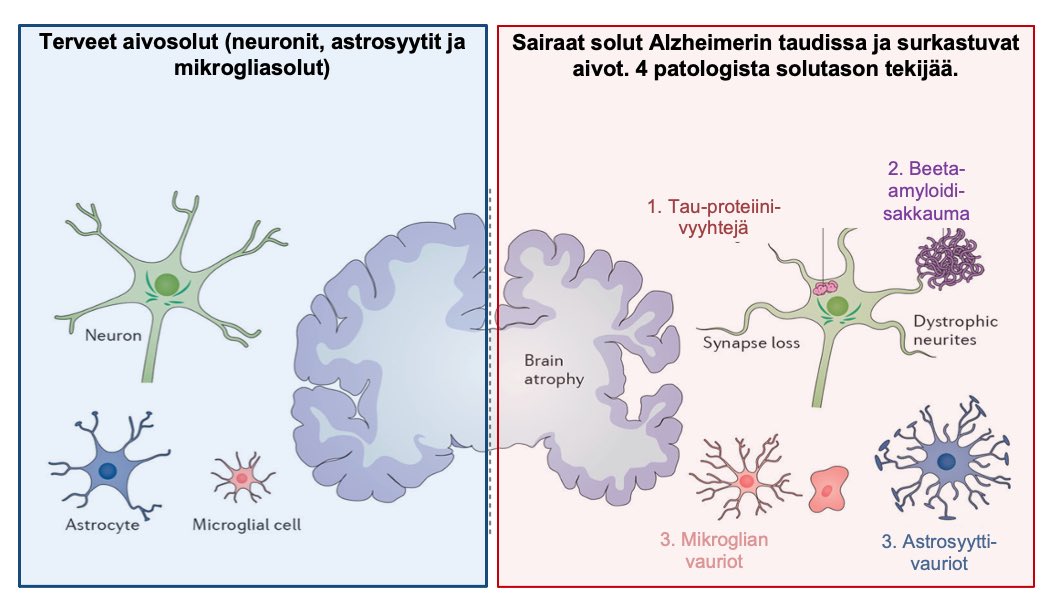
Mukaeltu: Congdon EE, Sigurdsson EM. Tau-targeting therapies for Alzheimer disease. Nat Rev Neurol. 2018 Jul;14(7):399-415. doi: 10.1038/s41582-018-0013-z. PMID: 29895964; PMCID: PMC6463489.
On arvioitu, että Alzheimerin tautia on paitsi puhtaana itsenään myös sekamuotoisena, jolloin siihen yhdistyy alla kuvattu vaskulaarinen muistisairaus.
Viimeiseksi on hyvä todeta suomalaisen katsausartikkelin viisas lause:
” Tiedetään, että myöhäisiän Alzheimerin tauti on ikääntymiseen liittyvä monitekijäinen sairaus, jonka puhkeamiseen vaikuttavat useat aivoihin kohdistuvat stressitekijät.” Tanila H ym. Duodecim 2018;134:2511–8.
2. Verisuoniperäisen eli vaskulaarisen muistisairauden yksinkertaistettu patofysiologia
Kuten aiemmin on todettu vuorisuoniperäinen muistisairaus kehittyy yleensä vuosikymmenen tai kaksi myöhemmin kuin Alzheimerin tauti. Verisuoniperäisen muistisairauden taudinkuva voi olla myös jossain määrin erilainen kuin Alzheimerin taudi. Esimerkiksi muisti säilyy jonkin verran paremmin kuin Alzheimerin taudissa, ja joktin käytöshäiriöt, kuten aggressiivisuus, voivat olla vähäisempiä. Oireet myös alkavat nopeammin Alzheimerin tautiin verrattuna, jopa päivissä tai viikoissa. Lisäksi oireet eivät etene tasaisesti vaan usein portaittain, ja välillä voi olla parempiakin päiviä.
Verisuoniperäinen muistisairaus voi johtua joko suurten tai pienten aivosuonten taudista. Kognitiivisten häiriöiden kannalta korostuu pienten suonten merkitys, mutta toki perinteisesti korostetut isojen verisuonien tukokset tai verenvuodot voivat aiheuttaa muistiongelmia.
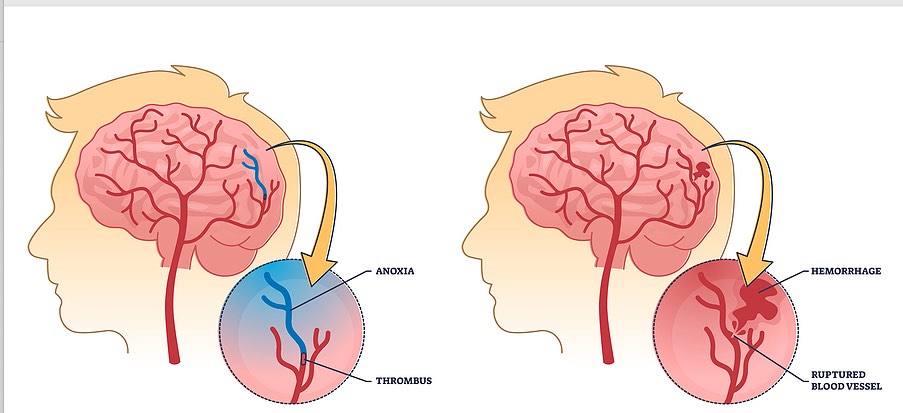
Verisuoniperäinen muistisairaus voi kehittyä pienten tai isojen verisuonten ateroskleroosin vuoksi, amyloidiangipatian (kts. teksti) tai suuremman aivoverenvuodon takia, tai näiden yhdistelmänä.
Muistisairaus voi syntyä aivoverisuonessa syntyvien ateroskleroottisten muutosten vuoksi – samankaltaisesti kuin sydämen sepelvaltimoon tulevassa tukoksessa. Toinen mahdollisuus on aivoverenvuoto pienessä tai isossa aivoverisuonessa. Pienten suonten infarktit ja verenvuodot voivat olla ”hiljaisia”, huomaamatta jääviä, aiheuttaen vain vähäisiä oireita verrattuna isojen aivoverisuonten infarkteihin tai vuotoihin. Kolmas yleinen mahdollisuus amyloidiangipatia (katso edellinen kappale), jossa pieni aivoverisuonen toiminta on rappeutunut beta-amyloidin kertymisen vuoksi; seurauksena on yleensä mikroverenvuoto tai hypoperfuusio (aivoalueen huono verenkierto). Amyloidiangiopatiaan liittyy usein myös samanaikainen Alzheimerin tauti.
3. Sekamuotoinen muistisairaus
Väestön ikääntyessä on käynyt selväksi, että yksille ja samoille ihmisille voi hyvin kehittyä yhtä aikaa sekä Alzheimerin tauti että verisuoniperäisiä muistisairauksia. Onkin esitetty, että sekamuotoista muistisairautta olisi yhtä paljon tai enemmän kuin kumpaakaan puhdasta sairaustyyppiä (Strandberg ym. 2020) .
Geriatrian emeritusprofessori Timo Strandberg on kirjoittanut aiheesta varsin valaisevan artikkelin, joka on kaikkien luettavissa täällä.
Edellä esiteltiin otsolohkorappeumaa, hippokampuksen skleroosia, Levyn kappaletautia ja Parkinsoninin tautia muistisairauksien syynä. Nämä sairaudet esiintyvät vähäisemmässä määrin väestössämme kuin edellä mainitut, ja niitä on tutkittu vähemmän. Lisäksi niihin liittyvät suojaavat ja lisäävät riskitekijät ovat samat kuin Alzheimerin taudissa ja verisuoniperäisessä muistisairaudessa. Täten en esittele näitä sairauksia tarkemmin tässä kirjoituksessa.
Lopuksi
Edellä esitettyjen muistisairauksien patofysiologian keskeisten seikkojen ymmärtäminen ensiarvoista, jotta voidaan tutkia miten paitsi lääkehoidot myös ravintovalinnat saattavat vaikuttaa muistisairauksien taustalla. Seuraavassa kirjoituksessa paneudun muistisairauksien biomarkkereihin, erityisesti verestä mitattaviin muistisairauksien riskitekijöihin. Sen jälkeen tulee vuoroon erilaiset ravintovalinnat ja muistisairaudet.
Lähteet
Busche MA, Hyman BT. Synergy between amyloid-β and tau in Alzheimer’s disease. Nat Neurosci. 2020 Oct;23(10):1183-1193. doi: 10.1038/s41593-020-0687-6. Epub 2020 Aug 10. PMID: 32778792.
DeSimone CV, Graff-Radford J, El-Harasis MA, Rabinstein AA, Asirvatham SJ, Holmes DR Jr. Cerebral Amyloid Angiopathy: Diagnosis, Clinical Implications, and Management Strategies in Atrial Fibrillation. J Am Coll Cardiol. 2017 Aug 29;70(9):1173-1182. doi: 10.1016/j.jacc.2017.07.724. PMID: 28838368.
Global Burden of Disease Collaborative Network. Global Burden of Disease Study 2021 (GBD 2021). Seattle, United States: Institute for Health Metrics and Evaluation (IHME), 2024. Available from https://vizhub.healthdata.org/gbd-results/.
Hampel H, Hardy J, Blennow K, Chen C, Perry G, Kim SH, Villemagne VL, Aisen P, Vendruscolo M, Iwatsubo T, Masters CL, Cho M, Lannfelt L, Cummings JL, Vergallo A. The Amyloid-β Pathway in Alzheimer’s Disease. Mol Psychiatry. 2021 Oct;26(10):5481-5503.
Hampel, H., Hardy, J., Blennow, K. et al. The Amyloid-β Pathway in Alzheimer’s Disease.Mol Psychiatry 26, 5481–5503 (2021). https://doi.org/10.1038/s41380-021-01249-0
Minhas PS, Jones JR, Latif-Hernandez A, Sugiura Y, Durairaj AS, Wang Q, Mhatre SD, Uenaka T, Crapser J, Conley T, Ennerfelt H, Jung YJ, Liu L, Prasad P, Jenkins BC, Ay YA, Matrongolo M, Goodman R, Newmeyer T, Heard K, Kang A, Wilson EN, Yang T, Ullian EM, Serrano GE, Beach TG, Wernig M, Rabinowitz JD, Suematsu M, Longo FM, McReynolds MR, Gage FH, Andreasson KI. Restoring hippocampal glucose metabolism rescues cognition across Alzheimer’s disease pathologies. Science. 2024 Aug 23;385(6711):eabm6131.
Muistisairaudet. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin, Societas Gerontologica Fennican, Suomen Geriatrit -yhdistyksen, Suomen Neurologisen Yhdistyksen, Suomen Psykogeriatrisen Yhdistyksen ja Suomen Yleislääketieteen yhdistyksen asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2023 (viitattu 14.11.2024). Saatavilla internetissä: www.kaypahoito.fi
Scheltens P, De Strooper B, Kivipelto M, Holstege H, Chételat G, Teunissen CE, Cummings J, van der Flier WM. Alzheimer’s disease. Lancet. 2021 Apr 24;397(10284):1577-1590. doi: 10.1016/S0140-6736(20)32205-4.
Strandberg T. Vanhuusiän muistisairaus – amyloidia vai ateroskleroosia? Erikoislääkäri 2017; 27(1): 7-10.
Strandberg TE, Tienari PJ, Kivimäki M. Vascular and Alzheimer Disease in Dementia. Ann Neurol. 2020 May;87(5):788. doi: 10.1002/ana.25715. Epub 2020 Mar 21. PMID: 32154602; PMCID: PMC7317452.
Tamaoka A, Sawamura N, Fukushima T, Shoji S, Matsubara E, Shoji M, Hirai S, Furiya Y, Endoh R, Mori H. Amyloid beta protein 42(43) in cerebrospinal fluid of patients with Alzheimer’s disease. J Neurol Sci. 1997 May 1;148(1):41-5.
Tanila H, Hiltunen M & Myllykangas L. Alzheimerin taudin patofysiologia – mitä uutta? Duodecim 2018;134:2511-2518
Zhang Z, Song M, Liu X, Kang SS, Kwon IS, Duong DM, Seyfried NT, Hu WT, Liu Z, Wang JZ, Cheng L, Sun YE, Yu SP, Levey AI, Ye K. Cleavage of tau by asparagine endopeptidase mediates the neurofibrillary pathology in Alzheimer’s disease. Nat Med. 2014 Nov;20(11):1254-62
Zhang Z, Tian Y, Ye K. δ-secretase in neurodegenerative diseases: mechanisms, regulators and therapeutic opportunities. Transl Neurodegener. 2020 Jan 6;9:1.
Yao Q, Long C, Yi P, Zhang G, Wan W, Rao X, Ying J, Liang W, Hua F. C/EBPβ: A transcription factor associated with the irreversible progression of Alzheimer’s disease. CNS Neurosci Ther. 2024 Apr;30(4):e14721.
Xiong, J., Kang, S.S., Wang, M. et al. FSH and ApoE4 contribute to Alzheimer’s disease-like pathogenesis via C/EBPβ/δ-secretase in female mice. Nat Commun 14, 6577 (2023). https://doi.org/10.1038/s41467-023-42282-7